In un mondo in cui gli stili di vita cambiano e si scoprono nuove malattie, i farmaci peptidici forniscono un raggio di speranza alle persone. I farmaci peptidici sono biologicamente attivi e meno tossici di altri farmaci. Hanno un ampio uso terapeutico, ad esempio, in oncologia, malattie cardiovascolari, diabetiche, ossee, ecc. Tuttavia, a causa del loro elevato peso molecolare e delle caratteristiche fisico-chimiche, la sintesi dei farmaci peptidici è complessa. Porta alla formazione di sottoprodotti e altre impurità che possono influire sulla sicurezza del farmaco. Qui discuteremo dei farmaci peptidici ciclici e del loro profilo di impurità. Questo blog è il secondo della serie Peptide.
Discutiamo prima-
Farmaci peptidici ciclici e loro importanza
I peptidi ciclici sono una classe di molecole che hanno attirato un'attenzione significativa nello sviluppo di farmaci grazie alle loro proprietà uniche, tra cui elevata stabilità, specificità del bersaglio, maggiore potenza e permeabilità cellulare. I peptidi ciclici sono catene polipeptidiche che assumono una struttura ad anello ciclico costituita da 5-14 amminoacidi con un peso molecolare compreso tra circa 500 e 2000 Da. La struttura ad anello può essere formata collegando un'estremità del peptide e l'altra con un legame ammidico o altri legami chimicamente stabili come lattone, etere, tioetere, disolfuro e così via.
La ciclizzazione della sequenza peptidica aiuta a legarsi in modo più efficiente con i rispettivi recettori. La struttura ciclica dei peptidi fornisce un'ampia superficie per l'interazione con il sito bersaglio. I farmaci peptidici ciclici sono impermeabili all'idrolisi enzimatica poiché non hanno estremità amminiche e carbossiliche libere, migliorando così la loro stabilità. Solitamente, i peptidi ciclici mostrano una migliore attività biologica rispetto alle loro controparti lineari a causa della struttura conformazionale, consentendo quindi un maggiore legame verso le molecole bersaglio o la selettività da parte del recettore.
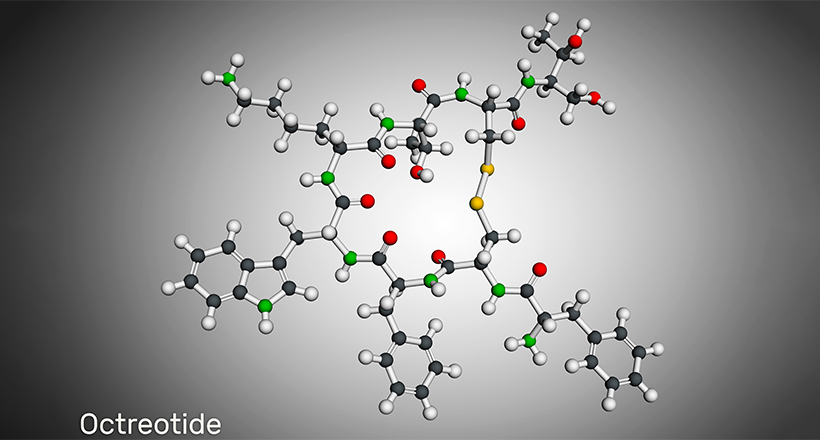
Alcuni farmaci peptidici ciclici includono daptomicina, Telavancina, Dalbavancina, lanreotide, Octreotide, linaclotide, Plecanatidi, romidepsina, Vasopressina, Ossitocinae calcitonina. Molti farmaci peptidici ciclici provengono da fonti naturali come la ciclosporina A, la batenecina, la lattociclina e altri. Tuttavia, i farmaci peptidici ciclici sintetici bioingegnerizzati stanno diventando comuni ora.
Come si sintetizzano i peptidi ciclici?
La sintesi dei peptidi ciclici prevede la sintesi peptidica in fase solida (SPPS). In questo metodo, la sintesi del peptide avviene linearmente, immobilizzato su una perla di resina con un linker disolfuro o altri legami chimicamente stabili come lattone, etere e tioetere. Dopo la formazione lineare del peptide, eventuali gruppi protettivi vengono scissi e i peptidi vengono rilasciati aggiungendo una base. Inoltre, la deprotonazione del gruppo tiolico N-terminale colpisce il collegamento disolfuro tra il peptide e la resina nella ciclizzazione intramolecolare, fornendo il peptide ciclico desiderato.
Nel complesso, la sintesi di peptidi ciclici richiede un attento controllo dei gruppi protettivi, dei reagenti di accoppiamento e delle condizioni di reazione per garantire rese e purezza elevate.
Tecniche per la sintesi di peptidi ciclici
La preparazione dei composti peptidici ciclici utilizza varie tecniche:
• chimica combinatoria
• sintesi de novo.
• ciclizzazione chemoselettiva mediata dalla ligazione
A seconda della ciclizzazione, i metodi per sintetizzare i peptidi ciclici sono testa-coda, catena laterale-catena laterale, catena testa-lato e catena laterale-coda. La ciclizzazione degli amminoacidi della catena laterale avviene con la formazione di ponti disolfuro tra la cisteina. Inoltre, la ciclizzazione da spina dorsale a spina dorsale avviene mediante la formazione di legami ammidici tra residui amminoacidici N-terminali e C-terminali.
Inoltre, ci sono altri peptidi ciclici come peptidi biciclici/triciclici e peptidi ciclici pinzati. I peptidi biciclici sono efficaci inibitori enzimatici e i peptidi pinzati facilitano la penetrazione delle cellule peptidiche e utilizzano reticolanti per migliorare le proprietà fisico-chimiche.
Impurezze nei farmaci peptidici ciclici
Le impurità possono derivare dalla sintesi di peptidi ciclici. Le impurità correlate all'API sono troncamenti, modifiche di gruppi funzionali, inserimento o cancellazione di amminoacidi, ossidazioni o riduzione di gruppi funzionali, aggregati e deprotezione incompleta. Anche i mezzi cromatografici utilizzati nella purificazione e i solventi possono contribuire alla generazione di impurità nei farmaci peptidici ciclici. I prodotti di degradazione si verificano a causa di cambiamenti nel prodotto farmaceutico conservato per lungo tempo o dell'esposizione alla luce, alla temperatura, all'acqua o alla reazione agli eccipienti. Per garantire la sicurezza e l’efficacia dei farmaci peptidici ciclici, è importante controllare e ridurre al minimo le impurità durante i processi di sintesi e purificazione.
Impurezze peptidiche generali come impurità N-Ac, deammidazione a Gln, residui di Asn, deamidazione al C-terminale, impurità di trisolfuro, residuo di cianoalanice @ Asn, des-Gly ed endo-Gly degli amminoacidi terminali sono comuni nei peptidi ciclici pure. Anche la degradazione e altri peptidi troncati rappresentano una delle principali classi di impurità in questi peptidi ciclici.
Oltre al tipo di impurità sopra descritto, nei peptidi ciclici si formano spesso altre impurità come dimeri paralleli e antiparalleli.
- Seq: Cys(1)-Tyr-Phe-Gln-Asn-Cys(6)-Pro-Arg-Gly-CONH2 (legame di zolfo tra cisteine)
- Dimeri paralleli: 1,1', 6,6'
- Dimeri antiparalleli: 1,6',1',6
- Seq: H-Asn-Asp-Glu-Cys(4)-Glu-Leu-Cys(7)-Val-Asn-Val-Ala-Cys(12)-Thr-Gly-Cys(15)-Leu-OH(4-12), (7-15)-bis(disulfide)
- Dimeri paralleli: 4,4', 7,7', 12,12', 15,15';
- Dimeri antiparalleli: 4,7',4',7, 12,15', 12',15; oppure 4,12',4',12,7,15',7',15 oppure 4,15',4',15, 7,12',7',12
- Seq: H-Cys(1)-Cys(2)-Glu-Tyr-Cys(5)-Cys(6)-Asn-Pro-Ala-Cys(10)-Thr-Gly-Cys(13)-Tyr- OH (3 ponti disolfuro tra 1-6, 2-10 e 5-13 di cisteine)

test